美国当地时间5月30日,上海科技大学免疫化学研究所研究员、生命科学与技术学院助理教授张璐,免化所特聘教授、清华大学教授饶子和院士团队与英国伯明翰大学Gurdyal S. Besra院士团队合作,在国际学术期刊《美国科学院院刊》(PNAS)在线联合发表了题为“Structure of the priming arabinosyltransferase AftA required for AG biosynthesis of Mycobacterium tuberculosis”的研究论文。率先解析了结核分枝杆菌细胞壁重要组成成分阿拉伯半乳聚糖(arabinogalactan, AG)合成通路中起始阿拉伯糖基转移酶AftA的三维结构,提出了AftA蛋白催化阿拉伯糖起始合成的选择特异性,对于理解结核杆菌细胞壁组装机制,阐明AftA作为潜在抗结核新靶点的工作机制和靶向性药物研发提供了理论基础。
结核病由结核分枝杆菌(Mtb)感染引起,一直是造成感染人数和死亡人数最多的单一传染病,至今仍然是传染病死亡的主要原因,特别是耐药结核分枝杆菌和HIV共感染等给公共卫生安全带来了前所未有的压力。结核分枝杆菌的细胞壁主要由糖类、脂类和糖脂类分子组成,高度复杂和独特,是病原体生长所必需,同时也是造成致病性和耐药性的关键因素之一。其核心骨架由AG外连分枝菌酸(Mycolic Acids, MA),内连肽聚糖(Peptidoglycan, PG)构成,当前使用的一线抗结核药物异烟肼、乙胺丁醇等均是通过抑制细胞壁合成发挥作用的,但结核分枝杆菌不同程度产生对一线药物的耐药性,因此针对抗结核药物靶点的研究以及新药的研发迫在眉睫。
AftA是细胞壁AG生物合成的一种必需的膜蛋白糖基转移酶,它负责起始转移第一个阿拉伯呋喃糖残基从供体癸烯基单磷酸阿拉伯糖(DPA)到成熟的半乳聚糖链上,起到桥联阿拉伯聚糖和半乳聚糖合成的作用,对维持细菌体外生长和细胞壁结构完整性至关重要,因此AftA是一个非常有潜力的药物靶点。AftA属于糖基转移酶C(GlycosylTransferase C, GT-C)超家族成员,与此前该团队解析的一线药物乙胺丁醇靶点Emb蛋白属于同家族。
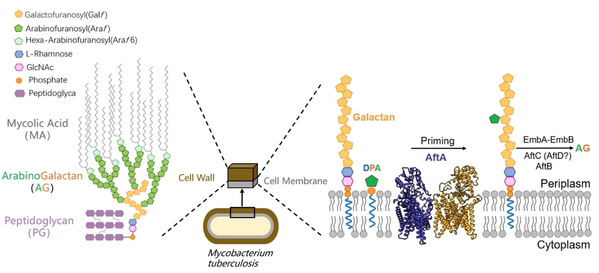
图1. Mtb细胞壁主要成分结构的示意图,AftA催化第一个阿拉伯糖基残基从供体DPA转移到半乳聚糖链
冷冻电镜结构显示AftA以二聚体的形式组装,与此前解析的EmbA-EmbB或EmbC2紧密结合的二聚体相比,两个AftA分子沿着垂直于膜平面的轴相对旋转,这种旋转导致更开放的AftA二聚体组装模式。通过基于结构指导的分子间交联实验,证实了AftA在分枝杆菌细胞膜上存在二聚体形式,与解析出的结构相一致。每个AftA分子包含由13根跨膜螺旋组成的N末端跨膜结构域(Transmembrane domain, TMD)和C末端可溶性结构域(C-terminal domain, CTD)。研究还发现一个钙离子处于TMD和CTD之间,作用可能是维持酶结构完整性。
研究团队将AftA结构与GT-C家族蛋白质进行系统性结构比对分析,找到GT-C类酶保守的由11个跨膜螺旋组成的跨膜区核心结构域(GT-C core)和由5个α螺旋与5个β片层(α5β5)组成的可溶区GT-C core。为了揭示AftA的半乳聚糖受体选择机制,研究团队利用体外糖基转移酶活性实验证实了直链的八聚半乳糖苷(LG8)是AftA的功能性受体;AftA负责在LG8的内部第6个呋喃半乳糖基残基的C-5位羟基上催化与供体阿拉伯糖的糖苷键形成,从而起始AG的阿拉伯糖精准合成。研究团队通过结构比对,体外酶活实验和分子对接等方法找到AftA蛋白的阿拉伯糖基供体和半乳聚糖受体的结构口袋和关键氨基酸位点,并在此基础上提出AftA催化的工作机制。此项工作还表明,尽管与EmbA/B/C酶属于同一GT-C超家族,AftA却不受乙胺丁醇的抑制,因此以AftA为新药靶点有望解决目前乙胺丁醇的耐药问题。
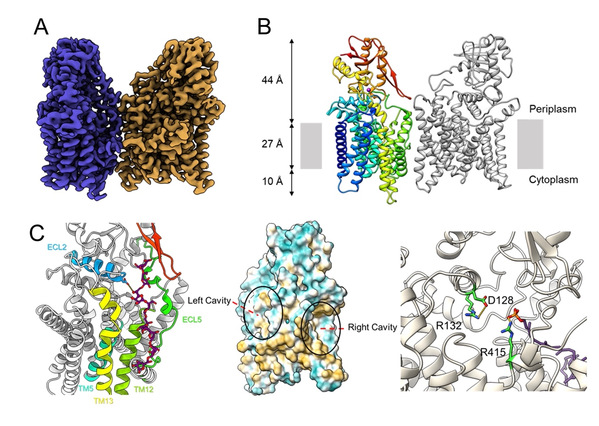 图2.(A)AftA的电势密度图(B)AftA二聚体的卡通模型。(C)中间AftA结构中的两个空腔,其中右侧空腔为供体结合口袋,通过结构比对,糖供体的磷脂部分位于所提出的供体腔内;左侧空腔为受体结合口袋,通过分子对接获得受体LG8结合的结构。
图2.(A)AftA的电势密度图(B)AftA二聚体的卡通模型。(C)中间AftA结构中的两个空腔,其中右侧空腔为供体结合口袋,通过结构比对,糖供体的磷脂部分位于所提出的供体腔内;左侧空腔为受体结合口袋,通过分子对接获得受体LG8结合的结构。
上海科技大学免化所/生命学院2022级博士研究生龚宜诚(张璐课题组)为本论文的第一作者。张璐研究员和Gurdyal S. Besra院士为本论文的共同通讯作者。饶子和院士和上海交通大学达林泰教授为共同作者。上海科技大学为第一完成单位。值得一提的是,此项工作是免疫化学研究所抗结核结构研究中心饶子和/张璐和伯明翰大学Gurdyal S. Besra联合攻关团队聚焦抗结核细胞壁合成膜蛋白靶点的又一项重要成果,为系统性理解Mtb独特复杂的细胞壁组装的分子机制和靶向细胞壁的抗结核新药发现提供了结构基础。此前该团队成功攻克长达半个世纪的乙胺丁醇药物作用靶点EmbA/B/C的结构解析难题,揭示了乙胺丁醇作用的分子机制(Science,2020),并获得中国2020年度重要医学进展。
相关链接:
本论文链接:https://www.pnas.org/doi/10.1073/pnas.2302858120
团队的其它相关研究:https://www.science.org/doi/10.1126/science.aba9102
分享自上科大官网,责任编辑刘玥,原标题《免化所张璐/饶子和团队与合作者揭示结核分枝杆菌细胞壁AG合成通路关键酶AftA的三维结构》。